新闻动态
政策法规返回首页
医疗器械注册申报一个产品需要多长时间
根据《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)和《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)中有关工作时限要求,审评相关各环节法定时限详见下表:
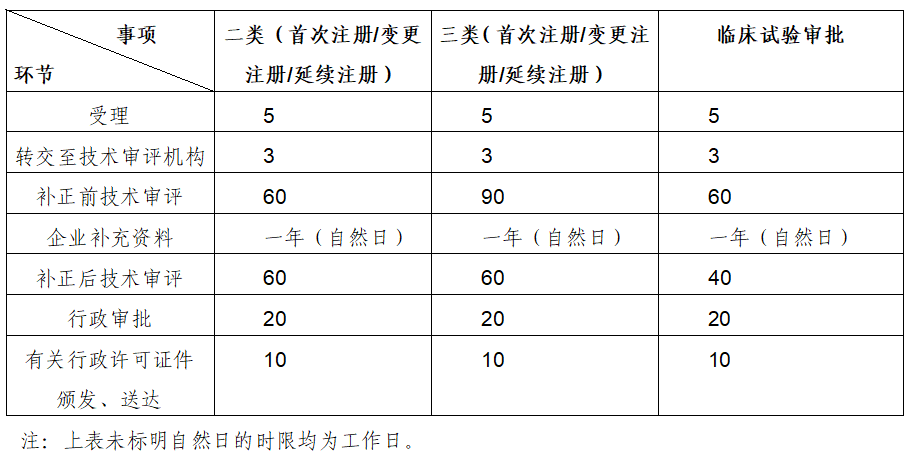
器审中心持续深化审评制度改革,不断强化审评能力建设,努力缩短审评工作用时。根据中心统计数据,2022年器审中心的审评工作总体用时按管理类别看,二类产品注册审评总体平均用时为72个工作日,三类产品注册为99个工作日;按申请事项看,产品首次注册审评总体平均用时为95个工作日,变更注册为64个工作日,延续注册为39个工作日。以上用时为当前统计平均用时,供大家参考。
需注意的是,以下时间不计入上述相关工作时限:
(一)申请人补充资料、核查后整改等所占用的时间;
(二)因申请人原因延迟核查的时间;
(三)外聘专家咨询、召开专家咨询会、药械组合产品需要与药品审评机构联合审评的时间;
(四)根据规定中止审评审批程序的,中止审评审批程序期间所占用的时间;
(五)质量管理体系核查所占用的时间。
医疗器械注册申报欢迎咨询 张经理13761666890












